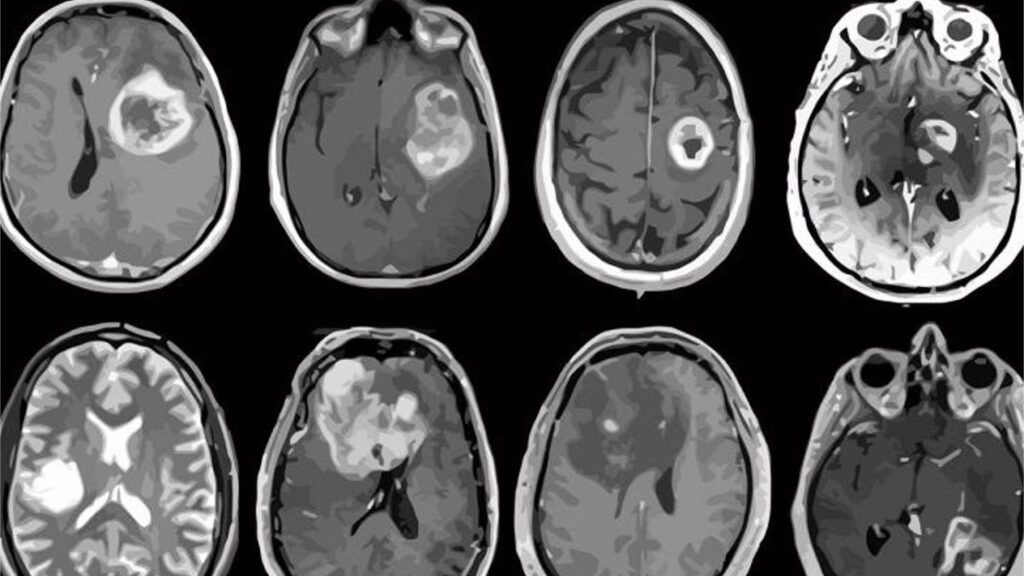
El panorama actual de los pacientes con glioblastomas, un tipo de tumor cerebral extremadamente agresivo, es muy delicado. Crece muy rápido, es invasivo, actualmente no se lo puede extirpar del todo con la cirugía y muestra resistencias a la radioterapia o quimioterapia.
A ese panorama, cuenta Marianela Candolfi, investigadora del CONICET que estudia el tema desde hace ya dos décadas, se le suma la falta de avances terapéuticos significativos. “Si comparamos 20 años atrás con el presente, pacientes de cáncer de mama o leucemia, por ejemplo, reciben hoy un pronóstico muy distinto. Pero con los glioblastomas no: es prácticamente lo mismo”, advierte.
Desde su laboratorio en el décimo piso de la Facultad de Medicina de la UBA, Candolfi y su equipo de investigación estudian, justamente, qué estrategias se pueden desarrollar para combatir este tumor, por el que mueren alrededor de 1600 pacientes adultos cada año en Argentina. Recientemente, en un estudio publicado en la revista Life Sciences, plantean cómo, a partir de un modelo en ratones, combinar dos terapias puntuales podría ayudar a combatir este tumor, con resultados muy promisorios.
El trabajo, que se enmarca en el área de ciencia básica, podría ofrecer soluciones a largo plazo, aunque por el momento, asegura la científica, “lo único que genera algún tipo de impacto positivo en glioblastomas son las mejoras en las técnicas quirúrgicas”. “Estos avances, incluso resonancias durante la cirugía, para analizar que no quedaran restos de tumor observables, lograron mejoras en la sobrevida de los pacientes. El tratamiento estándar, acá y en el resto del mundo, sigue siendo el mismo”, plantea, en diálogo con la Agencia CTyS-UNLaM.
Identikit de un enemigo complejo
Uno de los factores que complejizan el escenario para los glioblastomas, explica Candolfi, es la falta de un blanco terapéutico. Algo así como el “punto débil” del tumor: una molécula, un gen, un proceso específico de la célula cancerosa que, al atacarlo, se pueda frenar la enfermedad.
“Este tumor pareciera que tiene todos los mecanismos de resistencia posibles. Y a eso se le suma que tiene una naturaleza muy heterogénea y, a su vez, que hay heterogeneidad entre los pacientes. Creo que uno de los problemas es no entender que a este tipo de cáncer hay que atacarlo desde muchos ángulos”, plantea la investigadora.
Lo que sí se pudo avanzar en estos años de ciencia básica es cómo las lesiones en las células gliales -presentes en el cerebro- generaban tres tipos de gliomas: los glioblastomas, los astrocitomas y los oligodendrogliomas. Estos últimos dos suelen tener mejor sobrevida.
“Al estar bien caracterizadas las lesiones que caracterizan a los tres tipos, ese conocimiento permite diagnosticarlos fácilmente y dar un pronóstico mucho más acertado al paciente”, plantea la investigadora del CONICET.
Qué pasa con los gliomas en pacientes pediátricos
Con los gliomas pediátricos, asegura la investigadora, el panorama es más crítico. Con esta faceta, desde el grupo de Candolfi se empezaron a involucrar mucho más en los últimos años, a partir de la motivación que supone el pedido de familiares de pacientes con este tipo de cáncer. Además, hay un problema extra: la investigación en oncología infantil suele recibir menos financiamiento que cánceres de adultos.
“En general, los gliomas de alto grados en niños son peores que en adultos. Son más agresivos todavía. Algunos están ubicados en la línea media del cerebro, por lo que el tumor empieza a afectar a los centros respiratorios y centros cardíacos. La calidad de vida se deteriora rápidamente”, marca Candolfi.
El paso a paso para dar con una solución que promete
Con este escenario de base, el grupo, entonces, trabaja para obtener respuestas. ¿Qué sabían los científicos hasta el momento? Que hay una proteína llamada FOXP3 (resumen de “Forkhead box protein P3”) que regula la actividad de otros genes y, más importante aún, desempeña un papel clave en el funcionamiento de las células reguladoras del sistema inmune, llamadas células T regulatorias.
En términos normales, esta proteína FOXP3 evita que el sistema inmune se exceda y termine atacando al propio cuerpo. El problema es que, en algunos cánceres, como en glioblastomas, FOXP3 aparece también dentro de las células tumorales. Y allí ya no actúa como protector del cuerpo, sino como un guardaespaldas del tumor: las células inhiben la respuesta inmune antitumoral.
Entre otras cuestiones, por ejemplo, la proteína FOXP3 aparecía mucho más en cerebros con glioblastomas que en cerebros sanos. Y, al haber mayor cantidad de esta proteína, los pacientes mostraban un pronóstico peor y con tumores más resistentes a la quimioterapia.
“Vimos que FOXP3 tiene efectos intrínsecos en las células tumorales. Básicamente, son protumorales: favorecen la migración de estas células e, incluso, cuando le dábamos radioterapia a las células de glioblastoma, aumentaba también la expresión de FOPXP3- describe a la Agencia CTyS-UNLaM Matías García Fallit, primer autor del estudio e integrante del equipo-. Lo que nosotros planteamos es que el aumento de expresión de la proteína es una reacción que protege a la célula cancerosa de la citotoxicidad que le pueden generar estos tratamientos”.
Bloquear para avanzar
Con este escenario como base, lo que se propuso el grupo de Candolfi fue averiguar cómo impactaba bloquear FOXP3 -expresado en otros términos, “desactivar” esta proteína- para ver cómo respondía el tumor. En el proceso fueron claves los aportes del grupo de investigación del doctor Juan José Lasarte, del Instituto de Investigación Sanitaria de Navarra, España.
“Junto a su equipo, habían podido generar péptidos -una proteína con funciones muy específicas- que atravesaban las membranas celulares y podían bloquear FOXP3. La buena onda de ellos fue genial, nos mandaron por correo absolutamente todo lo que necesitábamos”, valora Candolfi.
El problema era como hacer llegar el péptido en cuestión -llamado P60- al área de interés en el cerebro. “Para que se pueda administrar de forma repetida y sostenida, generamos algo que se llama vector adenoviral, para que pudiera expresar este péptido en los tumores. Ahí pudimos ver que la administración de este virus con el péptido para bloquear a la proteína FOXP3 mejoraba la sobrevida de los ratones, aunque igualmente se morían todos. Cuando combinamos ese bloqueo con quimioterapia, logramos una sobrevida a largo plazo en un tercio de los ratones a los que les habíamos inoculado glioblastomas. Es decir, obtuvimos un mejor efecto con terapias combinadas que con una sola”, subraya Candolfi.
Desafíos, obstáculos y avances en el campo de la cirugía
Claro que enfrentar este enorme desafío implica la articulación y el diálogo de saberes. El doctor Andrés Cervio es jefe del Departamento de Neurocirugía de FLENI (Fundación para la Lucha contra las Enfermedades Neurológicas de la Infancia) y trabaja en varios proyectos de investigación junto al grupo de Candolfi. “Nosotros enviamos muestras de lesiones tumorales para que ellos puedan aislar y cultivar distintas líneas celulares. Así, pueden analizar la efectividad de los nuevos tratamientos”, especifica Cervio, en diálogo con la Agencia CTyS-UNLaM.
Con una amplia trayectoria y experiencia en el terreno de cirugías para este tipo de cáncer, el experto explica el panorama de los pacientes con glioblastomas. “Son lesiones con comportamientos agresivos y que paralelamente pueden afectar las distintas funciones cerebrales acorde a su localización– explica Cervio-. Pueden generar dolores de cabeza, convulsiones, alteraciones motoras, sensitivas, visuales o del lenguaje, así como de la esfera cognitivo-conductual”.
El tratamiento actual desde la medicina, cuenta, es multidisciplinario. En el caso de la cirugía, hay dos grandes objetivos. Por un lado, resecar la lesión para mejorar los síntomas secundarios a la compresión que ejerce el tumor sobre el cerebro. Por el otro, derivar la biopsia al neuropatólogo, quien, con distintas técnicas, realiza el diagnóstico de la lesión. “Esto es de fundamental importancia para que después el neuro-oncólogo ofrezca el tratamiento más adecuado para cada caso”, plantea el neurocirujano.
A su vez, los desafíos quirúrgicos de los glioblastomas suelen ser variados. “Primero se debe considerar el volumen de la lesión: a mayor tamaño, mayores riesgos de comorbilidades -detalla el especialista-. La localización es otra variable muy importante para la planificación quirúrgica que intente minimizar los riesgos postoperatorios”.
Herramientas de la cirugía para combatir al glioma
Hubo, eso sí, distintas tecnologías que colaboran para mejorar el tratamiento de los glioblastomas, como las secuencias de imágenes funcionales para la neuroradiología.
“En el quirófano, por otra parte, las técnicas de cirugía con pacientes despiertos han permitido que las resecciones tumorales sean más extensas. Al estar el paciente despierto durante el procedimiento se puede monitorear durante la cirugía la integridad de las funciones neurológicas que se quieren preservar”, plantea.
El otro campo es el de los neuronavegadores, instrumentos que permiten localizar la lesión tumoral durante la cirugía con gran precisión En este sentido, en el último año bioingenieros del Instituto ITBA desarrollaron, junto a expertos del FLENI, un software de realidad aumentada que permite replicar ciertas funciones del neuronavegador desde un celular inteligente, abaratando los costos operativos.
Nicolás Camargo Lescano (Agencia CTyS-UNLaM)